Ima jedan lijepi kemijski pokus za koji ne znam kada sam ga prvi put vidio ili kad sam ga prvi put izveo, ali znam kako sam se divio onome što je nastalo. Riječ je, da čitatelja ne držim u neizvjesnosti, o elektrolizi olovnog klorida ili neke druge soli dvovalentnog olova. Na katodi se izlučuje, razumije se, olovo u obliku metala ali ne i u obliku ravnog i glatkog sloja. Umjesto toga na elektrodi nastaje mnoštvo sitnih iglica i grančica. I kolikogod tako izlučeno olovo plijenilo oko (jako sliči na ono što dobivamo kad rastaljeno olovo izlijemo u vodu), takav sloj metala je baš ono što nijedan tehnolog ne želi vidjeti. Elektrokemijsko inženjerstvo poznaje naime postupke elektroplatiranja, no elektroplatiranjem (elektrolizom) nanesen sloj mora biti, razumije se, što homogeniji, ravnomjerniji. Stoga se mora raditi pri strogim uvjetima koncentracije elektrolita, gustoće struje i temperature, a često se u osnovni elektrolit još mnogo čega dodaje uz sol metala kojim se hoće elektroplatirati. Želimo li dobiti kvalitetan sloj olova, onda se ono mora nalaziti u obliku soli s tetrafluorobornom kiselinom, a elektrolit još sadržavati tetrafluorobornu i bornu kiselinu, sve u strogo određenim koncentracijama.
Zašto sve to pišem? Ne pišem radi olova nego radi litija. I kod njega dolazi do slične pojave, do izlučivanja u obliku grančica, dendrita. Da bi se to spriječilo, anoda litij-ionske baterije se izrađuje od grafita, kako bi se litij ugradio u njegovu kristalnu rešetku. (Što je katoda, a što anoda određuje se kod akumulatorskih baterija prema polu elektroda pri njihovom pražnjenju.) Time je izbjegnuto nastajanje dendrita no opet nije postignuta željena trajnost elektrode jer se pri ulasku (punjenju baterije) i izlasku litija (pri njezinom pražnjenju) remeti kristalna struktura grafita. Zbog toga baterija postepeno gubi kapacitet, posebice ako se puni i prazni do kraja (najbolje ju je držati između 20 i 80 % maksimalnog kapaciteta).
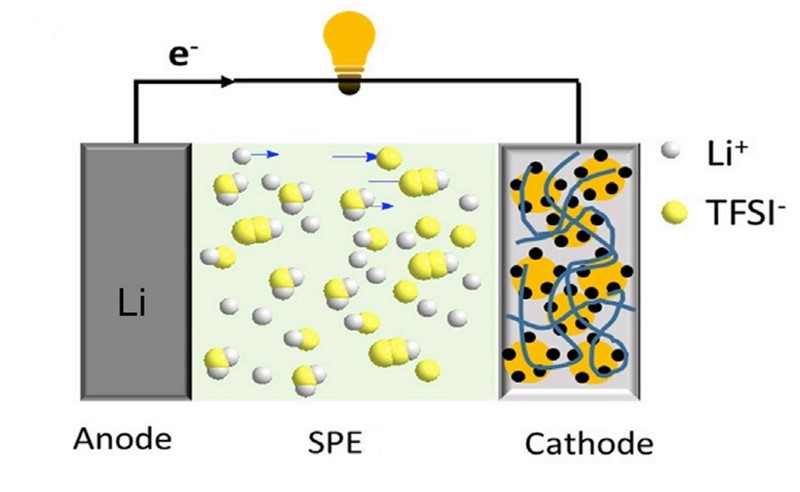
No evo rješenja i za taj problem. Našli su ga kineski znanstvenici. Rezultate istraživanja objavili su u časopisu Nature, u znanstvenom radu „Elastomeric electrolytes for high-energy solid-state lithium batteries“. Najjednostavnije rečeno, njihovo je rješenje u tome da su tekući elektrolit zamijenili elastomerom, pučki rečeno – umjetnom gumom.
Elastomer su dobili polimerizacijom na licu mjesta (in situ), naime reakcijom poli(etilen-glikol-diakrilata), PEGDA, i butil-akrilata, BA. No dobiveni elastomer ne vodi struju. Da bi je vodio, smjesi je prije polimerizacije dodana litijeva sol bis(trifluormetansulfonil)imida, LiTFSI, u smjesi s nitrilom jantarne kiseline (succinonitrile, SN). Nastala je heterogena smjesa elastomera i litijeve soli, drugim riječima umjetna guma s kanalićima kristaliziranog LiTFSI. Dobiveni materijal je bio rastezljiv ne samo zbog elastomera (PEGDA) nego i zbog plastičnosti kristala LiTFSI, koji služe kao elektrolit.
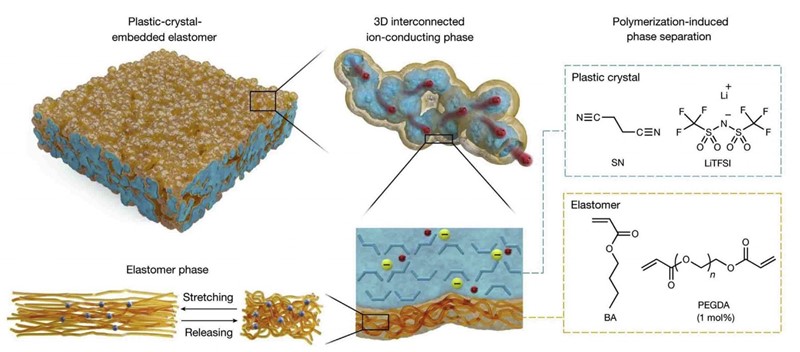
Rezultat: kineski su znanstvenici dobili polimerni elektrolit (solid polymer electrolyte, SPE) koji ne samo što ne može iscuriti, nego se može i po volji rastezati. No to je samo jedna od mnogih odlika nove baterije.
Zbog ravnomjernog toka struje (gibanja iona) litij se pri punjenju baterije izlučuje u jednolikom sloju. Budući da je katoda napravljena od istog elastomera kao i elektrolit (kojem je, za razliku od elektrolita, dodan LiFePO4), u bateriji nema oštre granice između elektrode i elektrolita, pa joj je unutrašnji otpor manji. Stoga baterija ima velik kapacitet (93 Ah/kg), a usto i veliku trajnost. Ni nakon 100 ciklusa punjenja i pražnjenja nije primijećeno stvaranje dendrita na anodi – baterija može izdržati i 1000 ciklusa bez veće promjene kapaciteta.

Uz mnoge prednosti nova vrsta baterije s krutim elektrolitom (solid state battery, SSB) se može napraviti i vrlo tankom. U baterija s katodom na bazi nikla, mangana i kobalta (LiNi0,6Mo0,2Co0,2O2) elektrode su bile razmaknute samo 0,025 mm – no u tom je slučaju nakon 100 ciklusa kapacitet snižen za 12 %.
Kolika bi mogla biti gustoća energije buduće baterije (veličina izražena u kWh/kg ili kWh/l) teško je reći, no mnogo znači to što se litij izlučuje u obliku metalnog sloja a ne vezan za grafit, alotropsku modifikaciju ugljika sa četiri puta većom gustoćom (2,27 g/cm3) od litija (0,53 g/cm3).

Nenad Raos je kemičar, znanstveni savjetnik u trajnome zvanju, koji je radio do umirovljenja 2016. godine u zagrebačkom Institutu za medicinska istraživanja i medicinu rada (IMI). Autor je i koautor oko 200 znanstvenih i stručnih radova iz područja teorijske (računalne) kemije, kemije kompleksnih spojeva, bioanorganske kemije te povijesti i prezentacije znanosti. Bio je pročelnik Sekcije za izobrazbu Hrvatskog kemijskog društva, glavni urednik Prirode te urednik rubrike Kemija u nastavi u časopisu Kemija u industriji. Još od studentskih dana bavi se popularizacijom znanosti. Autor je 3000 znanstveno-popularnih članaka te 15 znanstveno-popularnih knjiga – posljednja je “Kemičar u kući – kemija svakodnevnog života”.
Izvor:Bug.hr




