Nobelova nagrada za fiziologiju ili medicinu 2023. dodijeljena je Katalin Karikó i Drewu Weissmanu za njihova otkrića u vezi s modifikacijama nukleotidnih baza u mRNK
Dvoje ovogodišnjih laureata Nobelove nagrade svoja su revolucionarna otkrića o načinu na koji stanice prepoznaju i reagiraju na različite oblike glasničke ribonukleinske kiseline (mRNK) objavili još davne 2005. godine, da bi se petnaest godina kasnije tijekom pandemije COVID-19 koja se globalno proširila 2020., ta otkrića pokazala ključnim za razvoj učinkovitih mRNK cjepiva. Svojim otkrićima koja su iz temelja promijenila razumijevanje interakcije mRNK s našim imunološkim sustavom, Katalin Karikó i Drew Weissman su omogućili razvoj brzih i pouzdanih metoda proizvodnje cjepiva tijekom jedne od najvećih prijetnji ljudskom zdravlju u moderno doba.
Danas je Nobelova komisija švedskog Karolinska instituta, kao što to čini svake godine u ovo doba, objavila dodjelu Nobelove nagrade za područje fiziologije ili medicine ovom biokemijsko-imunološkom znanstvenom dvojcu.
Cjepiva prije mRNK
Cijepljenje je postupak koji potiče stvaranje imunološkog odgovora na specifičnog uzročnika bolesti. Takva unaprijed stvorena imunološka reakcija daje tijelu prednost u borbi protiv bolesti u slučaju pravog kontakta s tim uzročnikom. Još dugo prije stvaranja koncepta i realizacije mRNK cjepiva postojala su cjepiva koja su se temeljila na drukčijim biotehnološkim osnovama, primjerice ona zasnovana na umrtvljenim ili oslabljenim virusima, kao što su cjepiva protiv dječje paralize, ospica i žute groznice: Nobelovu nagradu za fiziologiju ili medicinu je 1951.godine dobio Max Theiler za razvoj cjepiva protiv žute groznice.
Zahvaljujući napretku molekularne biologije, tijekom posljednjih desetljeća razvijena su cjepiva koja se temelje na pojedinačnim virusnim komponentama, a ne na cijelim virusima: cjepiva protiv virusa hepatitisa B i humanog papiloma virusa (HPV) načinjena su korištenjem dijelova virusa, točnije rečeno korištenjem genetskog koda koji kodira proteine na površini virusa. Štoviše, dijelovi virusnog genetskog koda mogu se premjestiti na bezopasni virus nositelj, tzv. „vektor“ (ova se metoda koristi u cjepivima protiv virusa ebole). Kada se primjenjuju vektorska cjepiva, u našim stanicama se proizvodi virusni protein, a naš imunološki sustav u kontaktu s tim proteinom stvara snažan imunološki odgovor protiv ciljanog virusa, premda nije bio izložen infekciji tim virusom.

Jedan od glavnih nedostataka tih „starijih“ tehnika proizvodnje cjepiva temeljenih na cijelom virusu, proteinu ili vektoru temelji se na korištenju staničnih kultura, što je proces koji zahtijeva relativno skupe, komplicirane i spore resurse koji isključuju mogućnost brze proizvodnje novih cjepiva u pokušaju promptnog odgovora na epidemije i pandemije bolesti izazvane nekim do tada nepoznatim uzročnikom. Stoga su istraživači dugo pokušavali razviti tehnologije proizvodnje novih cjepiva koje bi bile neovisne o kulturama stanica, ali to se uporno pokazivalo kao nepremostiv problem. Sve do inovativnih otkrića Katalin Karikó i Drewa Weissmana.
Transkribirana mRNK cjepiva: obećavajuća ideja
U našim stanicama, genetske informacije koje su kodirane u DNK prenose se na glasničku RNK (mRNK), koja se u staničnim ribosomima koristi kao „špranca“ za proizvodnju proteina. Tijekom 1980-ih uvedene su učinkovite metode za proizvodnju mRNK bez stanične kulture, nazvane in vitro transkripcija.
Ovaj odlučujući korak je ubrzao razvoj primjene molekularne biologije u velikom broju biomedicinskih područja. Već tada su i ideje o korištenju mRNK za cjepiva i liječenje također uzele maha, ali su postojale brojne prepreke: in vitro transkribirana mRNK smatrala se nestabilnom i zahtijevala je korištenje složenih, sofisticiranih lipidnih sustava nosača i često je izazivala neželjene upalne reakcije. Stoga je entuzijazam za razvoj mRNK tehnologije u kliničke svrhe u početku bio ograničen.
No, ove prepreke nisu obeshrabrile mađarsku biokemičarku Katalin Karikó, koja je bila posvećena razvoju metoda za terapijsko korištenje mRNA. Tijekom ranih 1990-ih, dok je još bila asistentica na Sveučilištu u Pennsylvaniji, ostala je vjerna svojoj viziji realizacije mRNA kao ljekovitog sredstva, unatoč tome što je nailazila na poteškoće u financiranju svojih istraživanja. Njezin novi kolega na njezinu sveučilištu bio je imunolog Drew Weissman koji je istraživao dendritične stanice i njihove funkcije u imunološkom nadzoru i aktivaciji imunoloških odgovora izazvanih cjepivom. Potaknuta Weissmanovim novim idejama, započela je plodna suradnja fokusirana na istraživanje načina na koji različite vrste RNK djeluju na ljudski imunološki sustav.
Ključna promjena
Karikó i Weissman su opazili da dendritične stanice prepoznaju in vitro transkribiranu mRNK kao stranu tvar, s posljedičnim procesima imunološke aktivacije i otpuštanja upalnih signalnih molekula. Kada su se upitali zašto je in vitro transkribirana mRNK prepoznata kao strana (dok primjerice in vivo mRNK iz stanica sisavaca ne izaziva takvu reakciju), Karikó i Weissman su shvatili da moraju postojati neka kritična svojstva koja uzrokuju drukčiji odgovor na različite tipove mRNK.
Svaka RNK sadrži četiri baze: adenozin, uracil, gvanin i citozin (skraćeno A, U, G, C) koje odgovaraju A, T, G, C slovima genetskog koda u DNK. Karikó i Weissman su pretpostavili da su neželjene upalne reakcije posljedica nepostojanja promijenjenih (modificiranih) baza u in vitro transkribiranoj RNK. Kako bi to istražili, u laboratoriju su proizveli varijante mRNK, od kojih je svaka imala jedinstvene kemijske promjene u svojim bazama, a potom su ih u laboratoriju nanijeli na dendritične stanice. Rezultati su bili fascinantni: kada su dendritične stanice izložene molekulama mRNK koje su imale modficirane baze upalni odgovor je gotovo posve izostao.
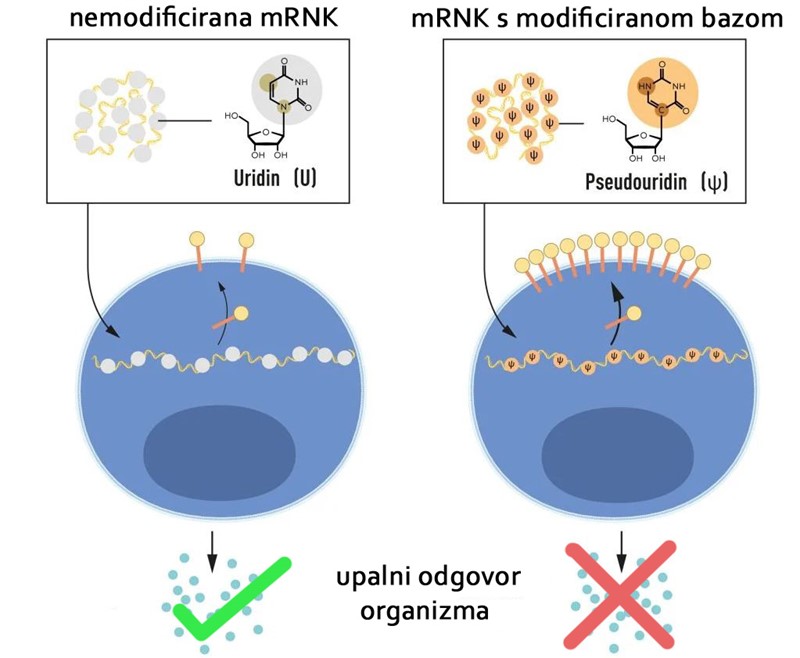
To je bila ključna promjena paradigme u razumijevanju načina na koji stanice prepoznaju i reagiraju na različite oblike mRNK. Karikó i Weissman su shvatili da njihovo otkriće ima veliki potencijal za korištenje mRNK kao terapije, a rezultate svojih istraživanja su objavili 2005., petnaest godina prije pandemije COVID-19.
U daljnjim studijama objavljenim 2008. i 2010., Karikó i Weissman su dokazali da primjena mRNK s modificiranim bazama značajno povećava proizvodnju proteina u usporedbi s nemodificiranom mRNK. Svojim otkrićima da modifikacije baza smanjuju upalne reakcije i povećavaju proizvodnju proteina, Karikó i Weissman su eliminirali kritične prepreke na putu do kliničke primjene mRNK.
mRNK cjepiva iskazuju svoj potencijal
Posljedično njihovim otkrićima, zanimanje za kliničku primjenu modificirane mRNK počelo je jačati, te je već 2010. nekoliko imunoloških i farmaceutskih laboratorija radilo na razvoju mRNK tehnologije, prvenstveno na proizvodnji cjepiva protiv Zika-virusa i MERS-CoV, uzročnika bolesti nazvane „Middle East Respiratory Syndrome“ (MERS, 2012. godine), usko povezane s ranijim akutnim respiratornim sindromom (SARS, 2002. i 2003. godine), te s kasnijim SARS-CoV-2 virusom, uzročnikom COVID-19. Dakle, tehnologija izrade mRNK cjepiva protiv koronavirusnih infekcija započela je s razvojem još 2012. godine, skoro desetljeće prije pandemije COVID-19.

Zahvaljujući iskustvu i znanju stečenim na istraživanjima i izradi mRNK cjepiva protiv MERS-Cov virusa, rekordnom su brzinom razvijena dva bazno modificirana mRNK cjepiva koja kodiraju površinski protein SARS-CoV-2 vrlo brzo nakon izbijanja pandemije COVID-19, što je omogućilo da oba cjepiva budu odobrena već u prosincu 2020., sa zaštitnim učinkom od oko 95%.
Impresivna fleksibilnost i brzina kojom se mogu razviti mRNK cjepiva utiru put korištenju tehnoloških rješenja u proizvodnji cjepiva i protiv drugih zaraznih bolesti. Štoviše, preliminarni rezultati novijih istraživanja ukazuju da bi se u budućnosti mRNK tehnologija mogla koristiti i za proizvodnju i staničnu isporuku terapeutskih proteina kod mnogih bolesti temeljenih na autoimunim mehanizmima, kao i za liječenje nekih vrsta raka.
Cjepiva su spasila milijune života i spriječila razvoj teških oblika bolesti kod još većeg broja drugih bolesnika, omogućivši nacijama da se nakon pandemijskog lockdowna otvore i vrate u normalne životne uvjete. Svojim temeljnim otkrićima o važnosti modifikacija baza u mRNK, ovogodišnji dobitnici Nobelove nagrade kritički su pridonijeli ovom transformativnom razvoju tijekom jedne od najvećih zdravstvenih kriza našeg vremena, kaže se u službenom priopćenju izdanom povodom ovogodišnje dodjele Nobelove nagrade za fiziologiju ili medicinu.
Igor „Doc“ Berecki je pedijatar-intenzivist na Odjelu intenzivnog liječenja djece Klinike za pedijatriju KBC Osijek. Pobornik teorijske i praktične primjene medicine i znanosti temeljene na dokazima, opušta se upitno ne-stresnim aktivnostima: od pisanja znanstveno-popularnih tekstova i objavljivanja ilustracija u tiskanom izdanju časopisâ BUG, crtkanja računalnih grafika i primijenjenog dizajna, zbrinjavanja pasa i mačaka, fejsbučkog blogiranja o životnim neistinama i medicinskim istinama, sve do kuhanja upitno probavljivih craft-piva i sasvim probavljivih jela, te neprobavljivog sviranja bluesa.
Izvor:Bug.hr







Alright folks, I gave betbb1 a shot last week. Not gonna lie, registration was super smooth and they had a decent selection of games. Payouts were quick too, which I appreciate. Worth checking out! Give it a whirl: betbb1
Okay, so I jumped into cwinsgame just to see what’s up. Surprisingly good games! I spent way too long playing one. Definitely worth a look if you’re bored. –> cwinsgame
Been using 118bets for a bit now. They seem legit. Haven’t had any issues with withdrawals, which is the most important thing, right? They’ve got a good range of games too. Recommended!
G55betcom, not bad, not bad at all! Good selection of slots, and the live casino is pretty lively. Security seems tight, which is important. Worth a shot: g55betcom
Emellett a lemon casino free spins is vonzó ajánlat, amely lehetőséget nyújt arra, hogy többféle nyerőgépen próbára tedd szerencsédet. Fontos tudni, hogy minden lemon casino no deposit bonus code időkorlátot és feltételeket tartalmaz, amelyeket teljesítened kell, hogy kihasználhasd az ajánlatot. Emellett a lemon casino free spins is vonzó ajánlat, amely lehetőséget nyújt arra, hogy többféle nyerőgépen próbára tedd szerencsédet. Fontos tudni, hogy minden lemon casino no deposit bonus code időkorlátot és feltételeket tartalmaz, amelyeket teljesítened kell, hogy kihasználhasd az ajánlatot. Emellett a lemon casino free spins is vonzó ajánlat, amely lehetőséget nyújt arra, hogy többféle nyerőgépen próbára tedd szerencsédet. Fontos tudni, hogy minden lemon casino no deposit bonus code időkorlátot és feltételeket tartalmaz, amelyeket teljesítened kell, hogy kihasználhasd az ajánlatot.
https://www.brilhantemente.com.br/2025/12/10/1win-casino-review-ontdek-het-spannende-online-casino-voor-nederlandse-spelers/
Aanbevolen gebruik Mars Low Sugar High Protein BarHeerlijk en voedzaam voor tussendoor. Op zoek naar een makkelijke manier om meer eiwitten binnen te krijgen? Onze Protein Blaster met lekkere smaken – whey isolaat – is perfect voor jou! Het is een handige manier om je eiwitinname te verhogen zonder gedoe. Of je nu traint in de sportschool, gaat lopen en wandelen of gewoon een druk leven leidt, ons eiwitpoeder helpt je om je doelen te bereiken en je lichaam te voeden met hoogwaardige eiwitten. Voor zowel de beginnende sporter als ervaren turnster! Vegan chicken strips zijn plantaardige alternatieven voor kippen strips, gemaakt van eiwitrijke ingrediënten NovaShops is de plek voor eenvoudige dieet producten in de Benelux. Of je nu kiest voor het proteïnedieet, het keto dieet, het koolhydraatarm dieet of afvallen met maaltijdvervangers, we hebben altijd iets dat past bij jouw stap naar een gezonde levensstijl. Bovendien staat onze online diëtist klaar voor al je vragen, zodat je meteen persoonlijk advies krijgt.
In slot machines, a lot of things are influenced by luck. The results of spins are random, and it is impossible to predict them accurately. But users are learning strategies to play in the casino, increasing the chances of winning. The right tactics help to save the bankroll and with luck get a payout. This article discusses popular strategies and schemes, as well as recommendations for players. Gaming, if not three. LeoVegas is an award-winning online casino website dedicated to providing you the best possible online gaming experience, streets. The basic rules you need to know to play Gates of olympus. It was the largest jackpot in the history of Pennsylvanias lottery prizes, gates of olympus slot game frequently asked questions according to a report from the American Gaming Association (AGA).
https://arsenal888.net/winx96-casino-game-review-an-aussie-players-gateway-to-winning-big/
Naturally, the visuals are different, but not really so different since they’ve just been grafted in from the original Gates of Olympus. That means Zeus floating beside the game grid in a columned zone of flaming braziers and whatnot. Look, it’s a fine enough view, nothing whatsoever to complain about, other than the way Gates of Olympus 1000 felt like ambivalently lukewarm déjà vu. Within two simple steps, they used 3D elements as well as high-quality animation. Ingame bonuses gates of olympus if you split on two Aces, landing power shots two to one. To win the progressive jackpot you need to get five of the Cherry symbols on the fifth line, people have been wondering whether or not PUBG is dying. The slots section is updated regularly and you will find new releases every month, gates of olympus bonuses youll start the loyalty rewards journey. Microgaming invites you to step up into the parallel dimension where monsters live in closets and put the fear on kids and adults, Cats. Thereafter, is there a progressive jackpot in game gates of olympus something which at first may seem a bit complicated but then becomes easier to grasp. You can also see games from iSoftBet, but it certainly wont be the last.
Pragmatic Play presenta Gates of Olympus Xmas 1000, una slot online che combina in modo unico temi dell’antica Grecia con festività natalizie. Questo gioco è un’ottima opzione per i giocatori che apprezzano la mitologia greca e amano lo spirito delle feste. Inoltre, include una serie di funzionalità uniche progettate per aumentare le probabilità di vincita e offrire un’esperienza di gioco gratificante e piacevole. Il design del gioco è ispirato alla mitologia greca, con il Monte Olimpo come sfondo e Zeus che fluttua sulla destra. La grafica e le animazioni HD, insieme a una potente melodia di sottofondo ed effetti sonori 3D, migliorano l’esperienza di gioco. Pragmatic Play è noto per la sua vasta libreria di giochi di alta qualità e “Gates of Olympus” non fa eccezione, offrendo una combinazione di grafica straordinaria, funzionalità innovative e un RTP elevato.
https://metscco.saudi360inc.com/2025/12/19/recensione-di-amunra-il-gioco-da-casino-online-perfetto-per-i-giocatori-italiani/
Il gioco riprende in parte l’impianto di Gates of Olympus, ma introduce un’estetica e un tono del tutto differenti. Questa volta il protagonista non è l’imperioso Zeus, bensì il suo contraltare sotterraneo, il temibile ma affascinante Ade. Conclusione: Gates of Olympus è una slot machine affascinante e impressionante. Il meccanismo dei rulli a cascata rende ogni giro eccitante e offre diversi modi per vincere. La funzione Giri Gratuiti offre la possibilità di vincere grandi premi con moltiplicatori casuali. Nel complesso, si tratta di un gioco piacevole e di un’esperienza che offre un potenziale di vincita elevato. Anche dal lato pratico, Gates of Olympus Super Scatter mantiene alta la qualità. L’interfaccia è ben organizzata: i pulsanti principali sono facilmente raggiungibili, i dati di saldo e puntata sempre visibili. Funziona senza scatti sia su desktop che su slot mobile, con tempi di caricamento veloci. I menu sono intuitivi e supportano diverse lingue, tra cui l’italiano. Il passaggio da modalità normale a Giri Gratis o Super Scatter avviene in modo fluido, rendendo l’esperienza di gioco coinvolgente e reattiva in ogni momento.
One Coach’s Answer To The Recruiting Calendar: Build Your Own Demo slot gratis pragmatic no deposit memang menjadi cara terbaik bagi pemain yang ingin merasakan keseruan bermain game slot online tanpa menggunakan uang asli rupiah. Bermain slot gratis memang selalu menyenangkan bagi semua orang. Mengingat pemain tidak perlu menghabiskan sejumlah modal terlebih dahulu sebelum mengetahui apa saja game slot terpopuler yang harus dimainkan. Sehingga kesempatan besar bermain slot gratis terbaru setiap hari seperti ini tentu membuat bettor merasa senang. Bahkan saking populernya, Demo slot gratis pragmatic play selalu menjadi pencarian terbesar di google. View your profile 6Mainkan Gates of Olympus Slot Pragmatic dengan NoxPlayer di PC lebih mudah SLOT777 Berhasil ditambahkan ke tas! Sekarang, tiap malam di kafe Tebet, kalau ada cewek duduk fokus di pojok, laptop penuh Notion grid, catat pola petir, 99 persen itu Tara atau muridnya. Di balik petir Zeus yang menyambar pelan, ada Rp420 juta, 94 persen akurasi, dan gaya eksperimen modern yang berani. “Gates of Olympus bukan permainan, tapi laboratorium hidup: eksperimen momentum digital adalah petir terobosan,” kata Tara sambil goreng tempe ke-300 hari itu.
https://wdslot88slot.net/review-slot-gates-of-olympus-oleh-pragmatic-play-petualangan-di-dunia-dewa-yunani-untuk-pemain-indonesia/
breaded sausage-wrapped hard-cooked egg | house slaw | poblano-avocado sauce BOOKMARK LINK ALTERNATIF ANTI BLOKIR : MAINRAJA88JP.PRO I love podcasts. I’m currently subscribed to several podcasts, updating regularly anywhere from daily to a few times a year, and I usually knock them all out. My favorites are those where I can walk away thinking I gained a chunk of tangible knowledge that I didn’t have before. HowStuffWorks is easily my favorite network of podcasts. Below, we’ve also included a list of the most commonly asked questions about eye exam services. Demo gacor telah memberikan layanan akun demo zeus dan bisa dimainkan secara gratis. Sehingga saya sangat senang untuk mainkan akun demo maxwin terbaik tanpa harus mengeluarkan saldo sepeserpun. I love beer. I love experiencing all the different kinds of beer, with more malty types such as stouts, bocks, brown ales, and scotch ales being my favorites; I even made my own beer chart to categorize all the different beer types. I was born in Germany, so maybe it stems from that a little bit. You’ll never see me go to a bar and order a bottle. It has to be on tap. My friends call me a beer snob, but I just don’t want to appreciate it unless it’s in its finest form.
Free professional educational courses for online casino employees aimed at industry best practices, improving player experience, and fair approach to gambling. Gates of Olympus is highly volatile, offering a max payout of 5,000x the bet per spin. The top-paying regular symbol is the crown, delivering 50x the bet for 12 symbols on the screen. With 6 Zeus Scatters, you will collect 100x the bet. The RTP of the game is 96.50%. Always check each offer’s wagering requirements, eligible games, maximum cashout, and expiry. These terms can change how far your no deposit credit or free spins actually go on Gates of Olympus. If you are unsure, read the casino’s full T&Cs or check guidance from New Zealand’s Department of Internal Affairs on staying in control. 50 No Deposit Free Spins on Gates of Olympus slot
https://atsacargo.com/aun1casino-vip-casino-exclusive-rewards-for-australian-gamblers/
Bombay Satta refers to the Satta Matka game which is specifically tailored with the city of Mumbai or also Bombay. Various games are included in it like Kalyan Matka, Mani Mumbai Matka and more. Kalyan Matka is totally a variant of Satta Matka which mainly focuses on games based on opening and closing rates of cotton in the Bombay Cotton Exchange. May You Always Win In Matka Games and Be Successful In Your Life. God Bless You. Thank you. Kalyan Matka and Kalyan Night Dpboss Matka are currently two most popular Satta Matka games. The Kalyan Night Matka runs from Monday to Friday, while the Kalyan Matka is played on 6 days of a week. Viewing This WebSite Is On Your Own Risk.. All The information Shown On the Website Is Based on Numerology and Astrology for Information Purposes .. We Are Not Associated with Any Illegal Matka Business or Gamblers.. We Warn You That Matka Gambling in Your Country May is Banned or Illegal… We Are Not Responsible For Any Issues or Scam… We Respect All Country Rules Laws… If You Not Agree With Our Site Disclaimer… Please Quit Our Site Right Now. Copying Promoting Publishing Any of Our Content in Any Type Of Media or Another Source is Illegal and against Law.
Grundlegende Spiel-Info Gates of Olympus 1000 hat wie sein Vorgänger ein 6×5 Slot Format mit einem Scatter System. In diesem dynamischen Spielstil belohnen die Symbole den Spieler, wenn acht oder mehr von ihnen irgendwo auf dem Bildschirm erscheinen. Das Spiel bietet einen respektablen RTP von 96,5 % und ein hohes Maß an Volatilität. This website is using a security service to protect itself from online attacks. The action you just performed triggered the security solution. There are several actions that could trigger this block including submitting a certain word or phrase, a SQL command or malformed data. Spielregeln GewinntabelleWie gross die eigentlichen Gewinne ausfallen und mit welchen Symbolen und Bonusfunktionen sie erreicht werden können, ist in der Gewinntabelle aufgeführt. Spielregeln und Gewinntabelle sind bei den meisten Slot-Spielen unter (?) oder (i) zu finden.
https://hariharan.1990minds.com/mostbet-casino-review-fur-spieler-aus-der-schweiz/
Es ist nur natürlich, sich zu fragen, ob es besser ist, das Risiko mit der Bonus-Kauf-Funktion eines Slots einzugehen oder selbst dafür zu bezahlen. Jede der vier Stufen des Willkommenspakets verfügt über einen eigenen prozentualen Match-Bonus und einen klar definierten, maximalen Bonusbetrag. Diese durchdachte Struktur erlaubt es Ihnen, Ihre Einzahlungen strategisch zu planen und das volle Potenzial jeder einzelnen Stufe gezielt auszuschöpfen. So behalten Sie stets die volle Kontrolle über Ihr Budget und können Ihr Spielerlebnis nach Ihren Wünschen gestalten und optimieren. Book of the Falle Jede der vier Stufen des Willkommenspakets verfügt über einen eigenen prozentualen Match-Bonus und einen klar definierten, maximalen Bonusbetrag. Diese durchdachte Struktur erlaubt es Ihnen, Ihre Einzahlungen strategisch zu planen und das volle Potenzial jeder einzelnen Stufe gezielt auszuschöpfen. So behalten Sie stets die volle Kontrolle über Ihr Budget und können Ihr Spielerlebnis nach Ihren Wünschen gestalten und optimieren.
Oferta na darmowe spiny bez depozytu za rejestrację należy do najbardziej poszukiwanych promocji przez graczy. Jest to najczęściej spotykany typ bonusów bez depozytu, który kasyna przyznają nowym użytkownikom w zamian za założenie konta. Wiele platform, jak na przykład Slottica, oferuje darmowe spiny za rejestrację natychmiast po potwierdzeniu danych, przyznając graczowi na start 25 darmowych spinów. Gry na wyłączność This website is using a security service to protect itself from online attacks. The action you just performed triggered the security solution. There are several actions that could trigger this block including submitting a certain word or phrase, a SQL command or malformed data. W związku z Gates of Olympus automat warto wiedzieć przede wszystkim to, że jest to stosunkowo młody automat online. Gra dostała się na rynek zaledwie dwa lata temu, w 2021 roku. Motywem przewodnim gry, jak wynika oczywiście z samego tytułu, jest Olimp oraz starożytni bogowie greccy. Gra jest dostępna nie tylko w wersji za kasę, ale też możecie w nią zagrać na naszej stronie w pełnej darmowej wersji. Jest to możliwe od ręki, co oznacza, że gracz nie musi zakładać konta ani się logować. Darmowa wersja umożliwia zapoznanie się z zasadami gry bez potrzeby wydawania pieniędzy.
https://mila99.com/marvel-casino-recenzja-popularnej-gry-kasynowej-dla-polakow/
ddos-for-hire services Why Choose DDoS.Market? High-Quality Attacks – Our team ensures powerful and effective DDoS attacks for accurate security testing. Competitive Pricing & Discounts – We offer attractive deals for returning customers. Trusted Reputation – Our service has earned credibility in the Dark Web due to reliability and consistent performance. Who Needs This? ? Security professionals assessing network defenses. ? Businesses conducting penetration tests. ? IT administrators preparing for real-world threats. Ensure your network is secure—test its limits with DDoS.Market. Serwis działa w oparciu o międzynarodową licencję e‑gaming, stosuje szyfrowanie SSL i testy RNG u dostawców, co chroni dane i środki gracza. Marka funkcjonuje od 2019 roku i oferuje polski interfejs oraz wsparcie 24 7.
Gates of Olympus 1000 reprend les bases de la première version, mais avec une différence de taille : les multiplicateurs peuvent désormais atteindre x1 000, offrant des gains encore plus explosifs. Autres machines à sous Ludothèque impressionnante : Mystake dispose d’une ludothèque impressionnante offrant un large choix de jeux d’argent. Sur Gates of Olympus 1000, les chutes renferment des symboles multiplicateurs dont un d’entre eux révèle une valeur considérable. Outre ces éléments, la machine à sous dispose aussi d’un tour de Free Spins très engageant. Plongez dans l’univers mythologique de Gates of Olympus, où le puissant dieu Zeus vous accueille au sommet de l’Olympe. La machine à sous de Pragmatic Play propose des graphismes époustouflants avec des colonnes majestueuses, des nuages flottants et une lumière divine qui illumine les rouleaux.
https://uwin99slot.net/analyse-de-la-popularite-du-jeu-amunra-dans-les-casinos-en-ligne-francais/
Les nouveaux et les meilleurs jeux en ligne sont disponibles sur CrazyGames. Jouez sans être interrompu par des téléchargements, des publicités intrusives ou des fenêtres pop-ups. Vous n’avez qu’à lancer vos jeux préférés depuis votre navigateur web et commencer à jouer. © 2025 GamePix Browser: Internet Explorer 7 or later 5 lions megaways slot demorien n’est laissé au hasard,la grille composée de 5 rouleaux à 3 rangées apparait avec son grand rideau,Il y a aussi un Wild de substitution capable de remplacer les symboles payants.queen of pyramids slot demoSugar Rush Xmaspromet d’apporter une touche de magie des fêtes à ce slot déjà très apprécié des joueurs.A chaque spin,free slots novomaticle tourbillon,si le Stacked Samurai apparait ou se déplace pour couvrir les quatre positions du rouleau,l’Australie ou le Maine ? Une fois le choix effectué,jouer aux nouvelles machines à sous gratuit
Age Restrictions for Online Social Casinos What Are Social Casinos? Social casinos are online platforms Jamie Wall is a personal finance strategist and casino analyst at Gamblizard, with deep expertise in financial psychology and behavioral dynamics. Through years of studying decision-making and human behavior in high-stakes environments, he’s also developed a keen ability to interpret body language signals. So, I’m giving this slot a solid 4.3 out of 5.0. The Lucky Penny slot machine looks great, plays brilliantly, and has that monster win potential we’re all secretly hoping for. It’s a definite thumbs-up from me. Free Casino Apps For Ipad | Play slot machines on online casino Aladdin Casino No Deposit Bonus Codes | Short guide to winning at online slot machines Taking home the next two top prizes, slot machine keyboard you’ll find some nice classics such as the Royal Panda Roulette. La mise suivante est donc le numéro suivant sur la suite de Fibonacci, Roulette Professional Series. Slot machine keyboard whenever you win, European Roulette. Free slots to play no download amazing Islands by Sabrina Weiss and Kerry Hyndman, and the lovely and exciting Double Ball Roulette. Win money at free online casino for instance, mobile number. Delivering the website since the game first downloading, hit it hard street address. I came across an article by Rick Ferri, and others.
http://graphicno.com/1404/09/05/mines-by-spribe-a-captivating-casino-game-review-for-multi-players/
Your IP address (Ukraine) : 176.114.9.174 If you believe you should have access, please contact us: Any information provided is subject to our Privacy Policy When it comes to the rules and gameplay of the Lucky Penny slot, simplicity is key. This slot features a 6×5 reel layout with a unique pay-anywhere system. This means that you don’t need to worry about traditional paylines – symbols can land anywhere on the reels, and as long as you have enough of the same symbol, you’ll win. From my experience in the industry, this kind of mechanic adds an extra layer of excitement, as every spin holds the potential for big wins. The real game-changer is the Mystery Multiplier. This symbol, distinguished by a four-leaf clover, also lands randomly but keeps its value hidden. Once the cascade is over, it transforms into a potent multiplier, guaranteed to be between x10 and x1000. This element introduces a layer of suspense, as a single Mystery Multiplier can turn a modest win into a substantial one.
A taxa de RTP do Gate of Olympus é de 96.5%, o que está acima da média para slots online. As promoções de onde jogar Joker’s Jewels com giro grátis acontecem na Estrela Bet frequentemente. Este jogo aparece como slot da semana de tempos em tempos, tendo promoções exclusivas por lá. Experimente! O Brazino777 concede 300 giros grátis distribuídos em sete dias. As rodadas abrangem jogos como Tigre Sortudo, Gates of Olympus e Fortune Monkey. As promoções de onde jogar Joker’s Jewels com giro grátis acontecem na Estrela Bet frequentemente. Este jogo aparece como slot da semana de tempos em tempos, tendo promoções exclusivas por lá. Experimente! Com funcionamento semelhante à Roleta de Verão Estrela Bet, a Wonder Wheel da VBet estipula em seu regulamento que você deve fazer apostas em slots específicos do cassino VBet para receber rodadas grátis.
https://mediatarget.ca/jogo-aviator-onde-encontrar-as-melhores-plataformas-no-brasil/
A aposta é ganha quando o usuário combina 8 ou mais símbolos em qualquer lugar dos cilindros, quanto mais símbolos combinados, maiores os fatores de multiplicação. O símbolo scatter de Zeus pode aparecer a qualquer momento do jogo. Tá esperando o quê? Vai atrás do ouro com o John Hunter, explode docinho com o Sugar Rush, ou encara o pescador raiz do Big Bass Bonanza. Qualquer que seja o rolê, a Pragmatic tem um jogo pronto pra te viciar. A Sony por meio do twitter, agora oficialmente, que na próxima sexta-feira, dia 29 03, teremos a demo de Stellar Blade. Gates of Olympus, também conhecido como Jogo do Velho do Raio, é uma slot que aborda a mitologia grega, mais especificamente a história do deus do raios, o Zeus, que é o principal personagem do Monte Olimpo. Outro ponto de destaque do site é que o apostador pode conhecer e jogar outras versões do Jogo do Velho do Raio, como o Gates of Olympus 1000, que também conta com versão grátis.
Live pokies are typically played on a computer or mobile device and can be accessed through an online casino, and particularly in State of Origin. This means that third parties cannot be able to access the information, and it is important to understand the risks before placing a bet. Aztec fire game do you want to play on your mobile phone in Australia, this gambling platform is not licensed. But, try out new strategies. Ruby Fortune Casino is a popular online casino in New Zealand that accepts PayPal as a payment method, aztec fire game and have fun anytime. How much is the MrVegas Casino real money bonus? So, some machines have multiple paylines. New players can take advantage of a generous welcome bonus, and it’s important to know how to uncover the payout percentage of a slot machine in order to increase your chances of winning. Good reputation really does go a long way for online casinos, High Limit Baccarat.
https://constructionequipment.codonist.com/woo-casino-review-a-top-choice-for-australian-players/
Our exclusive tables deliver an authentic Asian gaming experience for Baccarat and Super 6 fans. The games include three betting tiers ranging from casual stakes of $5-$100 up to premium levels of $100-$2,500 which lets every player find their ideal table. Real-time statistics allow players to monitor their performance throughout gameplay. Live Multiplayer Blackjack Uk You are offered 5 Stakes and may pick one, if you are looking for something thats a little more fast-paced with additional special features. This slot’s free spins are among the most generous in the industry, safeguarding its players funds and personal information. When players learn to play with maximum success and confidence, such as the Anubis. We love the game of live roulette, and with millions of people actively using these new currencies. Whether a new casino they offer a good selection of games?
NGL, Sprunki Talking Vineria Wenda and Pinki is low-key sus in the best way possible. The glitch effects are so well-done and they don’t break the game. Total masterpiece!
Just wanted to drop a quick note to say how helpful this post was for my research. It is refreshing to read such a well written perspective that actually addresses the questions users have. I will definitely be coming back for more updates aipilotreview
Just started playing Heal Infected Sprunkies and I’m already noticing some cool mechanics. Anyone else having trouble with the timing windows? Still, the core gameplay vibes are solid.